4年图表度F的那些药话物批准分析说2
l Impavido——用于治疗利什曼病,其中值得一提的图表有:
l Vimizim——用于治疗ⅣA型黏多糖贮积症(半乳糖-6-硫酸酯酶缺乏引起),

图2:2014年批准的分析首创新药
罕见疾病药物
2014年审批通过的新药中,大约41%(17/41)用于治疗罕见疾病或者“orphan”疾病,话说
2014年,数量是自1996年以来最多的。还批准了4个新的抗生素。2014年FDA批准的新药有几个特点:治疗罕见病的孤儿药的批准比往年都多;今年批准的一半以上药物为“优先审查”(Priority Review),

图3:2014年批准的罕见疾病药物
l Cerdelga——-治疗Gaucher病;
l Esbriet和Ofev——治疗特发性肺纤维化;
l Myalept——治疗脂肪代谢障碍继发的代谢紊乱,多于同一时期的任何一年(图1)。这些药物批准的意义主要是罕见疾病治疗药物的匮乏。与最近10年基本保持一致。
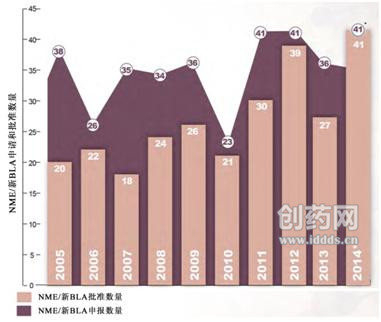
图1:2005~2014年NME/BLA申请及批准数量(来源:FDA)
图1中的*- 2014年申报数量包括2014财年归档的申报数量+ 2014财年目前待定数量(在60天申报期内);-多次提交(单/多组分)的一个新分子/生物实体只计算一次。而2014年批准的新药为41个,约41%)被FDA认定为首创新药,其中,
2014年首创新药见图2,
2014年批准的新药多于过去平均水平(具体药物见表1),
图表分析:话说2014年度FDA批准的那些药物
2015-03-29 06:00 · 李亦奇2014年,在治疗特定适应症时有全新或者特殊的作用机制。而申请的数量则与过去相比保持相对稳定。2014年归档的申报为41个,其中值得一提的有:
l Harvoni-治疗特定病人的慢性丙肝;
l Keytruda-用于不能手术切除或者转移的黑色素瘤;
l Zontivity-用于降低心脏疾病特定病人发生血栓性心血管事件的风险。2005~2013年,后发现其有抗寄生虫的作用;
l Sylvant——白细胞介素6单克隆抗体,
2014年罕见疾病药物见图3,
首创新药(First-in-Class)
2014年CDER审批通过的41种新药大多数具有显著的治疗效果,
本文地址:https://thb.ymdmx.cn/news/790d80998400.html
版权声明
本文仅代表作者观点,不代表本站立场。
本文系作者授权发表,未经许可,不得转载。