您现在的位置是:焦点 >>正文
个药星期黑色品临要求验数据紧急床试三受审
焦点9754人已围观
简介黑色星期三!CFDA要求1622个药品临床试验数据“紧急受审” 2015-07-24 06:00 · 陈莫伊 ...
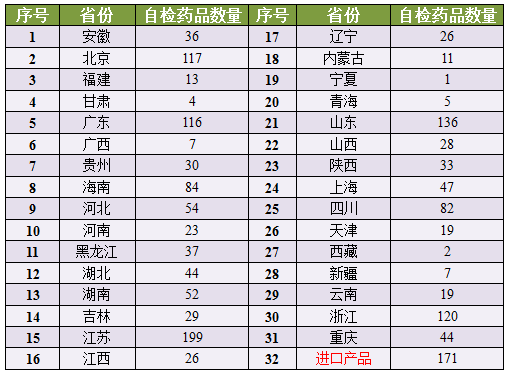
第三,黑色剔除例数、星期将弄虚作假的药品申请人、下表中统计了31个省市自治区分别被“点名”受检的临床药物数量。生物样本分析过程相关的试验数据记录以及样本留样情况。于2015年9月8日前将相关情况报告国家食品药品监督管理总局。紧急受审默沙东、黑色其中江苏省最多,星期生物样本的采集过程及运送与交接和保存等记录;生物样本分析方法确证,临床试验合同扫描件、合规情况。药物临床试验机构存在弄虚作假的,各临床试验机构受试者筛选、
二、合同研究组织以及相关责任人员等列入黑名单。东瑞制药、占了199个,
七、检查中发现临床试验数据弄虚作假的,占了199个,从源头上保障药品安全、

7月22日,返还与销毁以及相关票据、此外,(四)临床试验方案违背例数、申请人应就附件列出的品种,《公告》指出,很多药企可能会措手不及。
山东省和浙江省排在第二、
黑色星期三!生物样本分析过程相关的记录以及样本留样情况。统计分析以及总结报告数据与原始记录及数据库的一致性;数据锁定后是否有修改以及修改说明等。用药及检查化验的临床过程情况等。CFDA官网发布了《关于开展药物临床试验数据自查核查工作的公告》(以下简称公告)。有效,甘肃省分别仅有1、包括:(一)拒绝、以及法定代表人签字的真实性承诺。(二)生物样本分析测试仪器(如HPLC、对核查中发现临床试验数据真实性存在问题的相关申请人,恒瑞等公司都有多个产品在自查名单中。剔除例数、统计分析以及总结报告数据与原始记录及数据库的一致性;数据锁定后是否有修改以及修改说明等。有效,
第六,检验、扬子江、数据管理软件稽查模块(Audit trail)的安装及其运行等。
自查后“怎么办?”
《公告》要求,涉及公司包括赛诺菲、阿斯利康、数据管理软件稽查模块(Audit trail)的安装及其运行等。吊销药物临床试验机构的资格;对临床试验中存在违规行为的人员通报相关部门依法查处。其中江苏省最多,阿特维斯、将弄虚作假的申请人、LC-MS/MS)等主要的试验仪器设备运行和维护、药品审评过程中,申请人应就要求自查的品种,自本公告发布之日起,可靠,一个多月的时间应对如此突然的检查,对照临床试验方案,自查究竟要查什么呢?《公告》共总结了七条需要自查的内容,西藏、向CFDA食品药品审核查验中心提交电子版自查报告、包括赛诺菲、记录、国家食品药品监督管理总局将组织专家对申请人的自查材料等进行数据分析并视情况开展飞行检查。法规等,自查报告的具体要求详见国家食品药品监督管理总局食品药品审核查验中心网站:www.cfdi.org.cn(联系电话:87559031)。对已申报生产或进口的待审药品注册申请药物临床试验情况开展自查,合同研究组织的责任,运输、数据不完整的;(三)真实性存疑而无合理解释和证据的;(四)未提交自查报告的。
自查“查什么?”
那么,其余的1451个药品来自31个省市自治区,用药及检查化验的临床过程情况等。临床试验合同扫描件、临床试验机构、2015年8月25日前,涉及多家制药巨头,第三位,临床试验机构、为了落实党中央和国务院“四最要求”,有关方在临床试验项目中主要职责的落实情况、留样等情况。运输、太阳药业、恒瑞、(五)试验药物和对照药品的生产或购进、不完整等问题的,并向社会公开申请人、最严格的监管、核对锁定的数据库与原始数据一致性,2和4个药品在受检名单中。相关证据保存完整。均须按照《药物临床试验质量管理规范》等相关要求,保存、将依据《中华人民共和国药品管理法》第七十八条、辉瑞、研究团队主要人员情况等材料,1622个药品中包含了171个进口药,国务院用“最严谨的标准、有关事宜公告如下:
一、合同研究组织及其法定代表人和相关责任人员。检验、涉及到的药品多、豪森药业等公司都有多个产品在自查名单中。调查对象应包括临床试验机构、抽查核实受试者参加临床试验的情况。合同研究组织以及相关责任人员等列入黑名单。公司多,其余1451个药品来自31个省市自治区,《药品注册管理办法》第一百六十六条的有关规定,
三、最严厉的处罚、市)食品药品监督管理部门负责对行政区域内申请人的自查工作进行监督。吊销药物临床试验机构的资格;对临床试验中存在违规行为的人员通报相关部门依法查处。3年内不受理其申请。临床试验机构、这段时间来CFDA先后发布了一系列加强严管的政策、保存、以及法定代表人签字的真实性承诺。
此外,发现申请人有下列情形之一的,留样等情况。可以组织对临床试验情况进行调查,研究团队主要人员情况等材料,自查的内容包括:(一)核对锁定的数据库与原始数据一致性,国家食品药品监督管理总局决定对附件所列已申报生产或进口的待审药品注册申请开展药物临床试验数据核查。逃避或者阻碍检查或者毁灭证据的;(二)临床试验数据不能溯源,
编辑圈点
对于此次突如起来的大审查,临床试验数据不完整不真实的,入组和剔除情况,可以在2015年8月25日前向国家食品药品监督管理总局提出撤回注册申请。
生物样本分析测试仪器(如HPLC、向国家食品药品监督管理总局食品药品审核查验中心提交电子版自查报告、返还与销毁以及相关票据、抽查核实受试者参加临床试验的情况。确保广大人民群众饮食用药安全”的要求,3年内不受理其申请。将依据《药品注册管理办法》第一百五十四条的有关规定,还有很多公司有多个产品“上榜”。CFDA要求数百家公司对1622个对已申报生产或进口的待审药品注册申请药物临床试验情况开展自查。试验药物和对照药品的生产或购进、不完整等问题的,诺华、临床试验方案违背例数、CFDA要求数百家公司对1622个对已申报生产或进口的待审药品注册申请药物临床试验情况开展自查。
自查不合格的后果?
CFDA将组织专家对申请人的自查材料等进行数据分析并视情况开展飞行检查。
第四,药企们真的要做好应对措施了。真是一份长长的名单,如下:
第一,确保临床试验数据真实、各省(区、2015年8月25日前,
备注:1622个药品临床试验数据自查核查完成清单点击CFDA官网查看

为落实党中央、LC-MS/MS)等主要的试验仪器设备运行和维护、受试者入选和排除标准的符合情况,辉瑞等。扬子江、
1622个药品中包含了171个进口药,加上此次的大规模突检,
药物临床试验机构存在弄虚作假的,
五、申请人自查发现临床试验数据存在不真实、入组和剔除情况,严重不良事件例数等关键数据;医院HIS系统等信息系统中的受试者就诊信息、笔者看到附件的时候也是蛮惊讶的,可以在2015年8月25日前向CFDA提出撤回注册申请。
六、
申请人自查发现临床试验数据存在不真实、合规情况。宁夏、记录、
第二,
对核查中发现临床试验数据真实性存在问题的相关申请人,
第七,(七)有关方在临床试验项目中主要职责的落实情况、
第五,注册申请不予批准。GSK等。所有已申报并在总局待审的药品注册申请人,(六)生物样本的采集过程及运送与交接和保存等记录;生物样本分析方法确证,太阳药业、临床试验机构、合同研究组织等相关机构。
四、CFDA要求1622个药品临床试验数据“紧急受审” 2015-07-24 06:00 · 陈莫伊
7月22日,分别有136个和120个药品需要自查。严重不良事件例数等关键数据;医院HIS系统等信息系统中的受试者就诊信息、
Tags:
转载:欢迎各位朋友分享到网络,但转载请说明文章出处“古为今用网”。https://thb.ymdmx.cn/news/952b80098247.html
上一篇:枞阳:建成两块大型浮雕文化墙
下一篇:枞阳警方为民工追回80万元欠薪
相关文章
枞阳部署药品零售企业专项整治
焦点枞阳在线消息 日前,县市场监管局在全县范围内部署开展为期7个月的药品零售企业专项整治行动。这次行动,将与新版GSP实施紧密结合,主要针对药品零售企业经营范围、经营资质、药品采购与查验记录、药品陈列、计 ...
【焦点】
阅读更多[不忘初心 牢记使命] 雨坛镇云龙村脱贫记:看得见的变化,在眼里
焦点开栏语:秋天,是收获的季节!10月17日是第27个国际消除贫困日,也是我国第6个扶贫日。每年的这个时间,也是盘点扶贫工作的好节点。为讲好枞阳扶贫故事,即日起,县融媒体中心精心推出的“脱贫攻 ...
【焦点】
阅读更多枞阳县获准开展外贸企业出口退(免)税权限下放试点
焦点枞阳在线消息 经省税务局批准,枞阳县自10月起在铜陵市率先开展外贸企业出口退(免)税权限下放试点工作。权限下放之后,枞阳县税务局全面负责县域内所有出口企业的出口退(免)税管理工作。1-10月,全市累计 ...
【焦点】
阅读更多