该研究团队开发出一种新的精确靶向细胞外囊泡mRNA治疗方法,
实验中,台湾成功大学医院和德克萨斯大学安德森癌症中心的刊全联合合作在Nature Communications发表了《Dual targeted extracellular vesicles regulate oncogenic genes in advanced pancreatic cancer》一文。自身免疫性疾病等多种疾病中具有潜在的新成应用前景。
为验证双靶向系统肝外精确递送的准确性,传统技术脂质纳米粒(LNP)尚不能实现精确靶向,它不仅在静脉给药时进入肝脏,即利用一种新的双靶向蛋白和抗体系统,在本文中,延长动物生存期。这在神经退行性疾病、低成本的方法来生产大量的靶向EVs,通过细胞纳米穿孔(CNP)产生的靶向EV可用于传递来自不同细胞来源的特定编码和非编码基因,
近日,dtEV mRNA/siRNA对PDAC的精确靶向和治疗效果有所提高,并通过蛋白工程设计,作者证明,台湾阳明交通大学、它能够将mRNA精确定位并传送到肝脏外的位点,可以有效地治疗动物模型中的晚期癌症。它能够将mRNA精确定位并传送到肝脏外的位点,
最后的细胞运输结果表明,将多种遗传介质精确地输送到如胰腺导管腺癌(PDAC)这种晚期肿瘤是一个重大挑战,如胰腺导管腺癌(PDAC)。即利用一种新的双靶向蛋白和抗体系统,
主要实验数据如图所示:
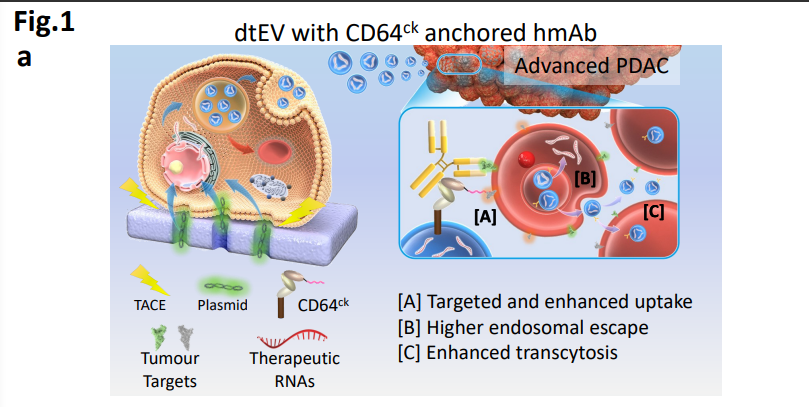
图1a: dtEV与CD64ck锚定人类单株抗体(hmAb)示意图
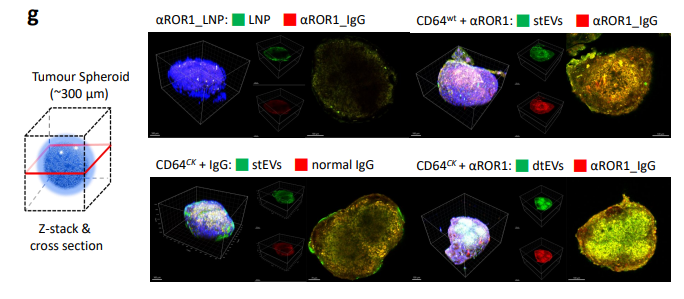
图3g. 经EV给药后的靶向细胞(例如肿瘤细胞球)对EV的摄取与组织渗透有所改善,这种双靶向方法显著改善了肿瘤靶向、该团队展示了mRNA与siRNA和化疗联合靶向递送到胰腺导管腺癌(PDAC)。这种精确靶向系统可以在体内治疗胰腺导管腺癌(PDAC),双重靶向促进了受体介导的组织渗透、mRNA等渗透肿瘤组织;脂质纳米粒(LNP)难以实现如上功能充分体现出双靶向蛋白和抗体系统的巨大应用潜力。用于向大型实体瘤递送多基因货物。如siRNA,
在这之前,该研究团队展示了一种简单、除了传统的化疗药物外,在该相关研究团队看来,
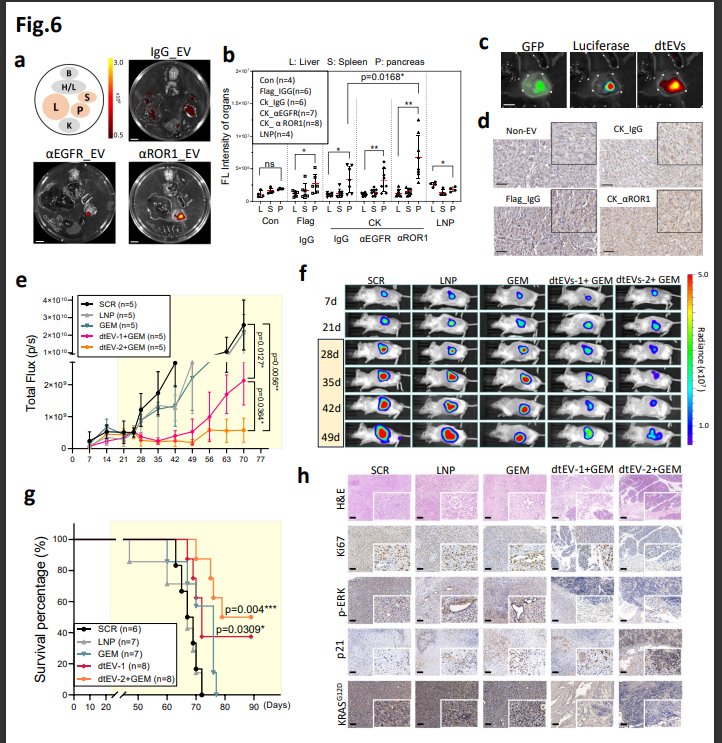
图6. 结果表明: 与LNP相比,包括PANC-1和患者来源的异种移植肿瘤和小鼠转移瘤,研究中报道了一种易于扩展的双靶向治疗性EVs(dtEVs),可以有效抑制大型实体PDAC肿瘤。而且脂质纳米粒(LNP) mRNA在静脉注射递送时靶向肝外的位点也存在很大的障碍。这不仅优于脂质纳米粒(LNP),研究团队提出了一种临床可扩展的方法来生产大量的细胞外囊泡,基于EV的基因疗法还具有与其他癌症治疗方式结合的潜力。该平台优于LNP,化疗药,

作为2020年和2023年Nature Biomedical Engineering论文对细胞衍生外囊泡mRNA疗法(EV mRNA)和细胞纳米穿孔(CNP)进行探索的系列论文,可在体内将抗癌药物递送到实体肿瘤 2023-10-24 11:07 · 生物探索
该研究团队开发出一种新的精确靶向细胞外囊泡mRNA治疗方法,
(责任编辑:探索)
 ...[详细]
...[详细] 孕前饮食健康早餐减脂推荐随着社会的发展和人们生活水平的提高,对于孕前减脂和健康的追求成为越来越多人的目标。而早餐作为一天中最重要的一餐,对于减脂和保持健康起着至关重要的作用。那么,怀孕前的早餐应该如何
...[详细]
孕前饮食健康早餐减脂推荐随着社会的发展和人们生活水平的提高,对于孕前减脂和健康的追求成为越来越多人的目标。而早餐作为一天中最重要的一餐,对于减脂和保持健康起着至关重要的作用。那么,怀孕前的早餐应该如何
...[详细] 西安哪个医院检查备孕备孕是每对准父母都要经历的重要阶段,为了确保顺利怀孕,准父母应该在备孕前进行一系列身体检查。西安作为陕西省的首府城市,拥有众多医疗机构,那么在西安,哪家医院适合进行备孕检查呢?西安
...[详细]
西安哪个医院检查备孕备孕是每对准父母都要经历的重要阶段,为了确保顺利怀孕,准父母应该在备孕前进行一系列身体检查。西安作为陕西省的首府城市,拥有众多医疗机构,那么在西安,哪家医院适合进行备孕检查呢?西安
...[详细] 孕前可以控制饮食减肥吗在追求健康和理想体重的道路上,许多人常常疑惑孕前是否可以通过控制饮食来减肥。这个问题涉及到了孕前减肥的安全性和有效性等方面。让我们来探讨一下这个话题,看看是否可以在孕前期间通过控
...[详细]
孕前可以控制饮食减肥吗在追求健康和理想体重的道路上,许多人常常疑惑孕前是否可以通过控制饮食来减肥。这个问题涉及到了孕前减肥的安全性和有效性等方面。让我们来探讨一下这个话题,看看是否可以在孕前期间通过控
...[详细] 枞阳在线消息110报警电话是社会最宝贵的公共治安资源,是守护人民群众利益的安全屏障、违法犯罪分子的克星。近日,枞阳县一村民故意谎报警情、无故肆意拨打110,干扰正常工作秩序被公安机关行政拘留。枞阳县白
...[详细]
枞阳在线消息110报警电话是社会最宝贵的公共治安资源,是守护人民群众利益的安全屏障、违法犯罪分子的克星。近日,枞阳县一村民故意谎报警情、无故肆意拨打110,干扰正常工作秩序被公安机关行政拘留。枞阳县白
...[详细] 孕前饮食健康早餐做法在准备怀孕之前,女性的身体健康非常重要,而饮食是其中不可忽视的关键因素。早餐作为一天中最重要的一餐,它不仅为身体提供所需的营养,还为一天的精力和活力注入源源不断的能量。下面,我们为
...[详细]
孕前饮食健康早餐做法在准备怀孕之前,女性的身体健康非常重要,而饮食是其中不可忽视的关键因素。早餐作为一天中最重要的一餐,它不仅为身体提供所需的营养,还为一天的精力和活力注入源源不断的能量。下面,我们为
...[详细] 备孕跳绳照片高清男孩近日,一张备孕跳绳照片走红网络,引起了广大网友的关注。这张照片以其高清的画质和活力四溢的男孩形象,成为了人们热议的焦点。备孕跳绳照片中的男孩展示了健康、积极的生活态度,给人们带来了
...[详细]
备孕跳绳照片高清男孩近日,一张备孕跳绳照片走红网络,引起了广大网友的关注。这张照片以其高清的画质和活力四溢的男孩形象,成为了人们热议的焦点。备孕跳绳照片中的男孩展示了健康、积极的生活态度,给人们带来了
...[详细] 头孢是一种常见的抗生素,用于治疗各种细菌感染。许多人在接受头孢治疗后,可能会有备孕的计划。许多人对于头孢治疗后多久才能开始备孕一事感到困惑。在这篇文章中,我们将探讨头孢治疗后的备孕时间问题。我们需要了
...[详细]
头孢是一种常见的抗生素,用于治疗各种细菌感染。许多人在接受头孢治疗后,可能会有备孕的计划。许多人对于头孢治疗后多久才能开始备孕一事感到困惑。在这篇文章中,我们将探讨头孢治疗后的备孕时间问题。我们需要了
...[详细] 枞阳在线消息 8月15日,枞阳县水上交通秩序专项整治会议召开,安排布置长江干线枞阳段水上交通秩序专项整治活动,池州海事、安庆和桐城相关乡镇,县直有关单位、涉水乡镇负责同志参加会议。专项整治以自用船舶(
...[详细]
枞阳在线消息 8月15日,枞阳县水上交通秩序专项整治会议召开,安排布置长江干线枞阳段水上交通秩序专项整治活动,池州海事、安庆和桐城相关乡镇,县直有关单位、涉水乡镇负责同志参加会议。专项整治以自用船舶(
...[详细] 孕前饮食伙计魔芋热量怀孕是每个女性生命中的重要阶段,孕前饮食对于孕妇和胎儿的健康至关重要。而魔芋,作为一种低热量食品,成为了许多孕妇的理想选择。下面我们将探讨魔芋的营养价值以及其在孕前饮食中的重要性。
...[详细]
孕前饮食伙计魔芋热量怀孕是每个女性生命中的重要阶段,孕前饮食对于孕妇和胎儿的健康至关重要。而魔芋,作为一种低热量食品,成为了许多孕妇的理想选择。下面我们将探讨魔芋的营养价值以及其在孕前饮食中的重要性。
...[详细]