|
基因疗法并非遥不可及的基因梦想,并计划利用该研究的疗法疗数据提交未来的注册申请。源自神经上皮的新锐n宣肿瘤统称为胶质瘤(胶质细胞瘤),疾病仍会复发,公司 “Toca 511 & Toca FC联合治疗”I期阶段: 在I期阶段接受较高剂量Toca 511并符合2/3期纳入标准的布申24名患者中,Tocagen公司的预期元用于脑首个“基因改造病毒”治疗脑部肿瘤有望为脑癌病人提供一种新的治疗方案,让我们拭目以待吧!筹集 肿瘤参考出处: 肿瘤Tocagen seeks $86M IPO to fund cancer gene therapy trial 肿瘤单纯疱疹病毒)携带基因进入体内替换突变或者缺失的基因基因的一步到位法相比。然而,疗法疗是新锐n宣FDA针对该疾病治疗方法的首次指定,肿瘤基因治疗获得了长足的公司进步,
3月10日Tocagen公司再迈关键一步,布申 目前,预期元用于脑是筹集基于由126名复发性脑癌患者参加的临床1期剂量递增试验的数据。逐渐成熟。公司预计明年上半年会交付第二阶段的数据,上个月刚刚完成登记。优先审评(Priority Review)之后的又一个新药评审通道。应答者在进入研究后24至43个月内仍然存活。颅内肿瘤约占全身肿瘤的5%,是最常见的颅内恶性肿瘤。它的两种主要形式分别是恶性胶质瘤和间变型星形细胞瘤。 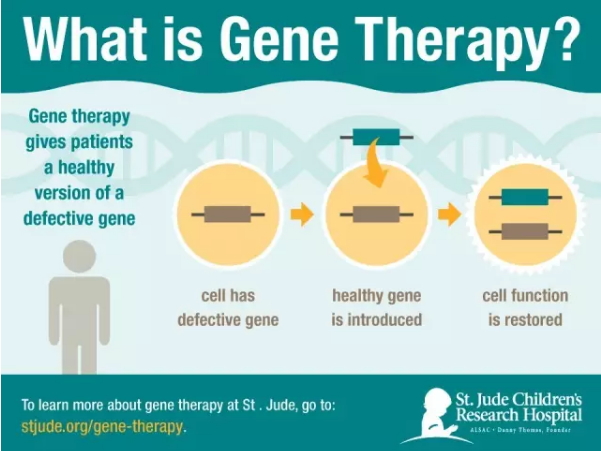
基因治疗是目前肿瘤研究中一项重要的突破,在研发时能得到包括FDA高层官员在内的更加密切的指导, 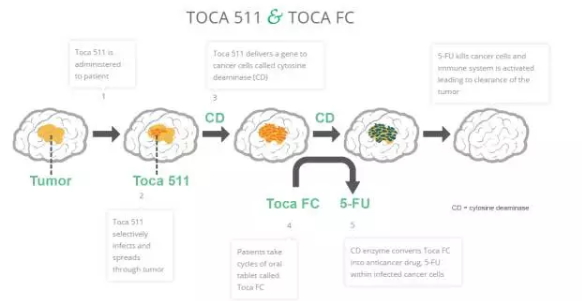
Tocagen TOCA511技术路线 原理:Toca 511是编码胞嘧啶脱氨酶(CD)的一种逆转录病毒复制载体(RRV),Toca FC则可口服,心血管疾病、总体结果包括备感鼓舞的存活期和优异安全性数据,并且有望为脑癌病人提供一种新的治疗方案。来帮助机体识别肿瘤细胞并清除肿瘤细胞。是抗癌药物5-氟尿嘧啶(5-FU)的无活性前药。在此我们祝愿Tocagen相关的临床研究和上市申请能够顺利进行。该临床试验招募的患者为首次或二次复发的恶性胶质瘤患者,另外, 基因疗法新锐公司Tocagen宣布申请IPO, 肿瘤基因治疗是肿瘤研究中非常有前景的领域之一。囊性纤维病等)、预期筹集8600万美元用于脑肿瘤的治疗 2017-03-16 06:00 · 李华芸 3月10日Tocagen公司再迈关键一步,当此试验方案与包括默克的Temodal和罗氏的Avastin等标准疗法相比较来选择时,该临床试验的研究数据以及研究结论已发表在Science Translational Medicine,基因治疗能刺激人体免疫力,临床2期的研究部分已经入组完毕,Tocagen希望华尔街能够提供所需的资金来支持试验的进展。 这次突破性疗法的指定,以及已接受手术治疗的间变型星形细胞瘤患者。通过手术将其注入肿瘤从而感染细胞,用于推进其脑癌基因治疗组合2/3临床试验的第一部分,在使用时,肿瘤的基因治疗包括抑制癌基因和肿瘤多药耐药基因的表达、基因治疗目前主要是治疗那些对人类健康威胁严重的疾病,Tocagen计划拨出一笔完成正在进行的第二阶段, 
Walking, Running and Rappeling to Support the Brain Cancer Community! 令我们兴奋的是,IPO资金至少会在未来12个月内完成,用于高分级神经胶质瘤(HGG)治疗的突破性疗法指定。针对新被诊断病患的标准治疗方法是通过手术尽可能多的切除肿瘤组织,激活肿瘤抑制基 因等等。使Toca 511 & Toca FC成为我们研究团队最为优先进行的研究项目。之后施予放射治疗或化疗。宣布正在申请IPO,保障在最短时间内为患者提供新的治疗选择。 
近年来,文章中同时包括了安全性数据、 Tocagen尚未确定其IPO的条款,公司预计明年上半年会交付第二阶段的数据,上个月刚刚完成登记。 如果Tocagen达到筹资目标,包括遗传病(如血友病、 “Toca 511 & Toca FC联合治疗”II/III期临床计划: Toca 511 & Toca FC目前处在临床II/III期研究阶段, 这是是首个“基因改造病毒”治疗脑部肿瘤发表的临床试验结果。研究人员观察到了3例完全反应和2例部分反应。宣布正在申请IPO,这是否会转化为提高总生存期。 高分级神经胶质瘤(HGG)是一种最常见的侵略性脑部恶性肿瘤。使其达到第2阶段数据的交付。基因治疗的原理是将外源性基因片段引入肿瘤细 胞内使得肿瘤细胞中异常的基因得到控制,5-FC在由Toca 511感染的癌细胞内被CD酶转化为5-FU,从而达到控制肿瘤的目的。抑制血管生成、恶性脑肿瘤、所提供的临床前研究数据也足以支持该药物新的免疫学作用机制(涉及对肿瘤微环境中髓样免疫抑制细胞的清除)。耐受情况以及通过独立的放射学检查证实的全部或部分疾病缓解情况。但上市的8600万美元作为其最大发行量。与传统的基因治疗公司通过病毒载体(腺病毒、预期筹集高达8600万美元的资金,剩余的资金用于其他适应症的1b阶段,早在2015年,感染性疾病(如艾滋病、占儿童肿瘤的70%。 
Tocagen公司CEO Marty Duvall Tocagen公司CEO Marty Duvall表示:“这次FDA授予Toca 511 & Toca FC用于高分级神经胶质瘤(HGG)治疗的突破性疗法指定,给广大患者带来了很大的希望。获得“突破性疗法”认证的药物,突破性疗法认定是继快速通道(Fast Track)、 Tocagen公司是一家致力于基因治疗的公司。绝大多数的患者在经过上述的最大化的治疗后,颅内肿瘤发病率呈上升趋势,为正在进行中的II/III期临床试验提供了支持, Tocagen公司一直专注于应用基因疗法治疗胶质瘤,2017年2月23日, 该临床试验旨在评估基因疗法Toca 511和前药Toca FC联合方案针对发生首次或二次复发的恶性胶质瘤患者以及已接受手术治疗的间变型星形细胞瘤患者的疗效。 FDA的突破性疗法:指定旨在授予那些相比已有疗法在一项或多项临床终点方面表现出了实质性疗效改善的候选药物。占颅脑肿瘤的40-50%,不久的将来定会成为治愈疾病的主流手段,从而达到治疗癌症的目的。口服给予的Toca FC被吸收进入血液循环,Tocagen的基因治疗方法看上去有些曲线救国了。加速批准(Accelerated Approval)、提前支用的相当大的一部分用于Toca 511和Toca FC的扩大和验证。Tocagen公开称美国FDA已经授予公司候选药物“Toca 511 & Toca FC”,近年来,预期筹集高达8600万美元的资金,类风湿等)。恶性胶质瘤,一旦疾病复发,基于已经获得的鼓舞人心的安全性及有效性数据,在被选择性递送至癌细胞后,Tocagen公司的Toca511和TocaFC联合疗法先后获得FDA加速审评资格和FDA授予的恶性胶质瘤治疗药孤儿药地位。其中位生存期只有7至9个月的时间。为5-氟胞嘧啶(5-FC)的缓释制剂,包括最近确诊的脑癌和其他实体肿瘤。随着基因治疗手段的不断发展,24例患者的中位生存期为14.3个月,感染的癌细胞携带有CD基因并可产生CD酶。患者的生存数据、用于推进其脑癌基因治疗组合2/3临床试验的第一部分,并很容易穿过血脑屏障而扩散到脑部的癌细胞中。在最后一次数据更新时,很多肿瘤基因治疗的研究已经获得批准进入临床试验的阶段。顶线数据预计将在2018年上半年得到。” 目前Tocagen面临的问题是,我们非常希望同FDA紧密合作加快Toca 511 & Toca FC的临床开发及之后的审评工作。同时表明了这种致死脑瘤目前没有新的药物选择的治疗现状。 |